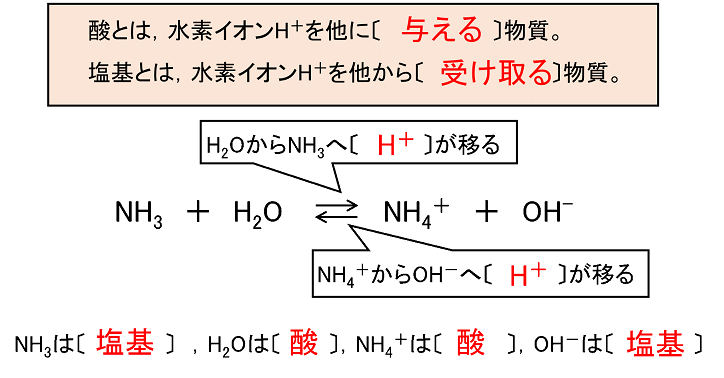
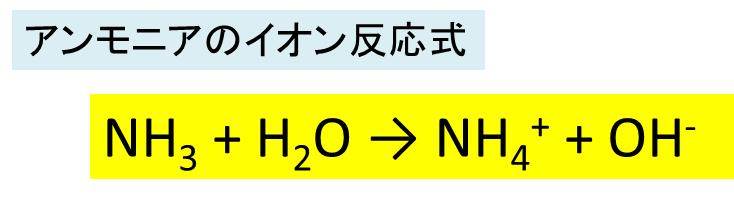
Jan 09, 09 · 化学 酸と塩基がわかりません (問)次の各反応式で、水は酸、塩基のどちらの働きをしているか。 水素イオンの授受によって説明せよ。 (1)nh3+h2o⇔nh4+oh (2) 質問noネットイオン方程式の定義 正味のイオン方程式は、 反応に関与する種のみを列挙した反応の化学式である。 正味のイオン方程式は、酸塩基中和反応 、 二重置換反応および酸化還元反応において一般に使用される。 換言すれば、正味のイオン方程式は「酸はH + を与える分子やイオンであり、塩基はH + を受け取る分子やイオンである」 と、広い意味で定義することにしました。
理論 酸塩基 1 受験 定期テストで高校化学を完全攻略
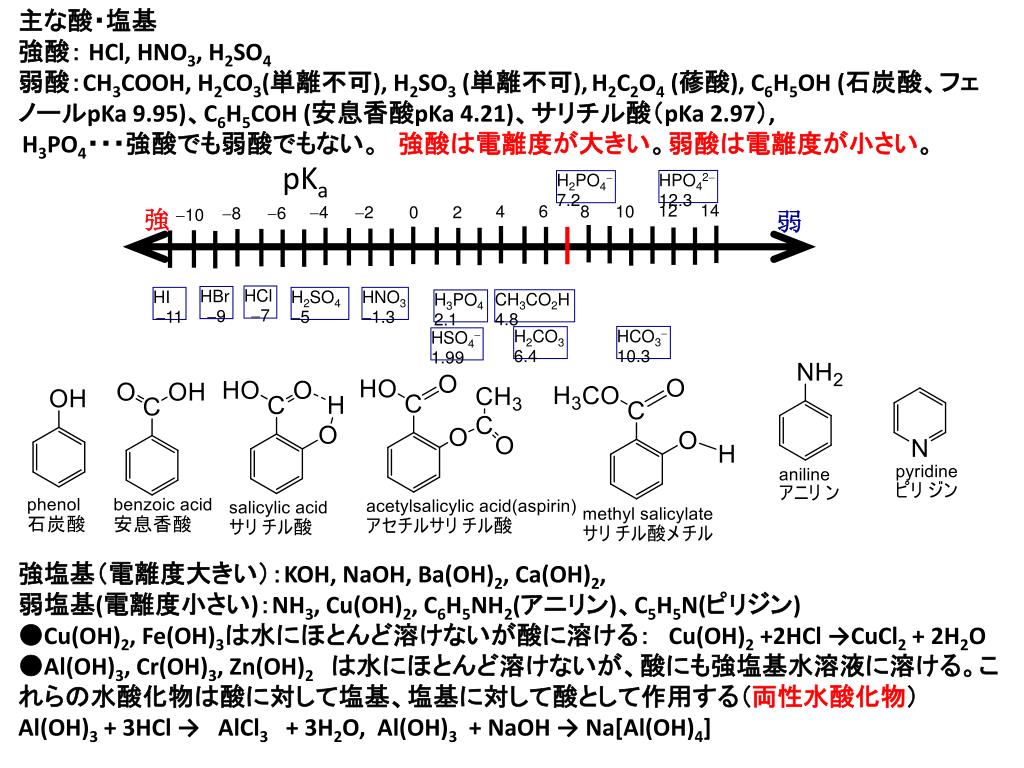
酸 塩基 化学式 一覧
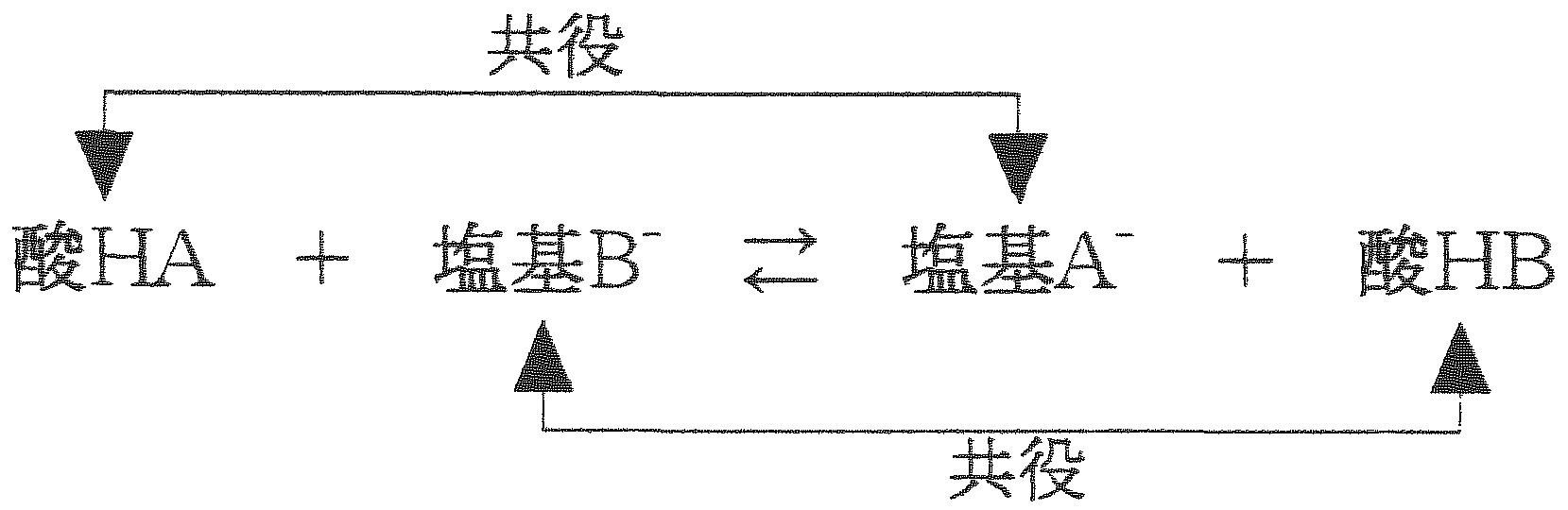
酸 塩基 化学式 一覧-酸・塩基の概念が化学反応のしくみを説明するものであることを説明できる。酸・塩基の化学式から酸・塩基の価数をつけることができる。 5週 酸と塩基(酸と塩基の強弱,水素イオン濃度,水素イオン濃度とpH) 電離度から酸・塩基の強弱を説明できる。酸を HA として、水 H 2 O と酸塩基反応させると、次のような化学反応式が書けます。ここで、プロトン H を電離したあとの Aを酸 HA の「共役塩基 (conjugate base) 」といい、プロトン H を受け取ったオキソニウムイオン H 3 O を水 H 2 O の「共役酸 (conjugate acid



Web教材イラスト図版工房 R Ch 酸と塩基 33
化学式 h 2 co 3 。二酸化炭素が水に溶けて生じる弱い二塩基酸。水溶液としてのみ存在する。炭酸の溶解度は共存する塩の濃度,水素イオン濃度,温度および二酸化炭素の分圧に比例する。アルカリ金属以外の金属塩は水に難溶である続いて、 弱塩基 です。 1価 アンモニアNH 3 2価 水酸化銅(Ⅱ)Cu(OH) 2 、 水酸化鉄(Ⅱ)Fe(OH) 2 3価 水酸化鉄(Ⅲ)Fe(OH) 3 少し聞きなれない物質が多いですが、アンモニアだけは必ず覚えておきましょう。 1価の弱塩基といえばアンモニア です。例として、1価の酸haに対して1価の塩基bohを滴下する中和反応を考え、縦軸にph、横軸に滴下量をとる滴定曲線を描いてみます。まず、酸haと塩基bohは水溶液中で電離するので、考慮すべき変数としては、ha, h , a –, b , oh –, bohの6種の濃度を考えることになります。
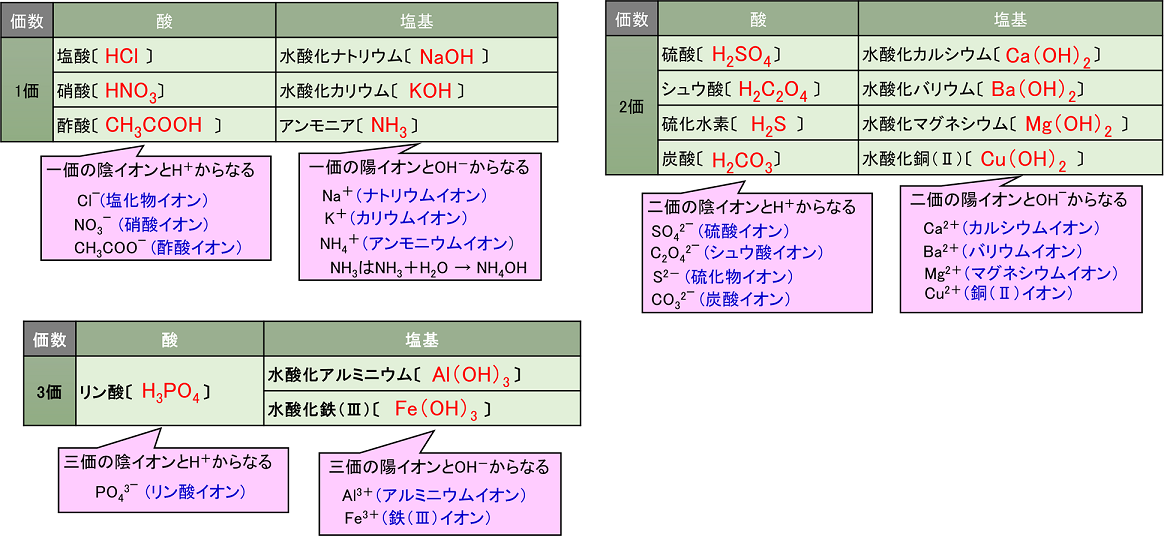
①酸化数 ②電子を含む式の書き方 ③酸化還元反応式 酸塩基反応は(私達が使うブレンステッド-ローリーの定義では)水素イオンH+の授受ですから、酸塩基反応の反応式を見れば、ほぼ即座に反応式中のどれが酸でどれが塩基であるか見分けがつきます。Apr , 21 · 酸の価数 とは、 酸1分子が出しうる水素イオンh の数 のことであり、 塩基の価数 とは 塩基1化学式が出しうる水酸化物イオンoh - の数または受けとることができる水素イオンh の数 のことです。 価数の覚え方としては、酸・塩基の化学式およびイオンの形を覚えることが最もベストNH 3 H 2 O → NH 4 OH
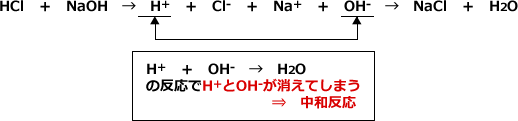
Home>教育> 分析化学>10酸塩基反応3 分析化学10 酸塩基反応3 pHダイアグラムの作成 pHダイアグラムの求め方 連立方程式 連立方程式は一見複雑だが、よく見ると暗記しやすい法則性がある。 計算結果を、Excelファイルにまとめた。酸と塩基が出会うと、酸の 「H」 と 塩基の 「OH」 がくっついて H2O (水)ができます。Nov , 19 · この記事では、化学基礎「酸と塩基」の解説をしていきます。この項のポイントは以下の3つです。ポイント酸と塩基水素イオン濃度とpH中和反応と塩の生成「酸と塩基」は、化学基礎の5つめの章ですが、前の章のmolが理解できている人なら問題ないでしょう




7 の水溶液が酸性になるのはnahso4でhがあるからですか Clear




化学 酸 塩基の化学式 カード暗記 高校生 化学のノート Clear
酸塩基反応は一般に、化学種間の水素イオンのやり取りと位置づけられます。 m HnA n B → m An n HmBm次の酸,塩基が完全に電離するとして,電離を表す反応式を書け。 ただし,多段階で電離するものは,一つにまとめた式で書け。 ( 1 ) HNO 3 ( 2 ) H 3 PO 4 ( 3 ) HOct 10, · 塩の液性を問う問題。なんとなくで問題を解いている人も多いかと思います。 なんなら、塩の液性は暗記だと思っている人も多くいますよね。 実は液性を見分ける方法は、コツがわかってしまえばとても簡単です。 今回は塩の液性の見分け方を、簡単にわかりやすく徹底解説したいと




化学基礎 酸と塩基2 ファミマプリント Famima Print




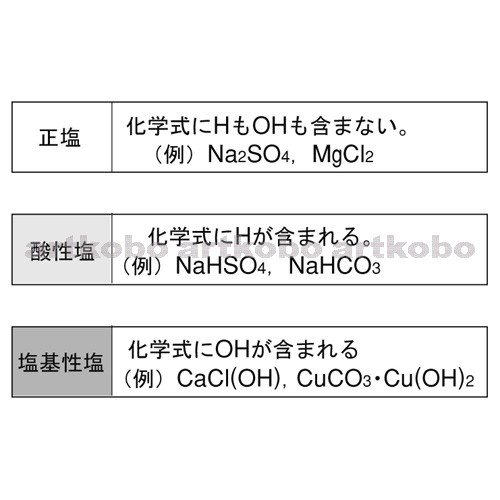
高校理論化学 塩の種類と水溶液の性質 塩の加水分解 受験の月
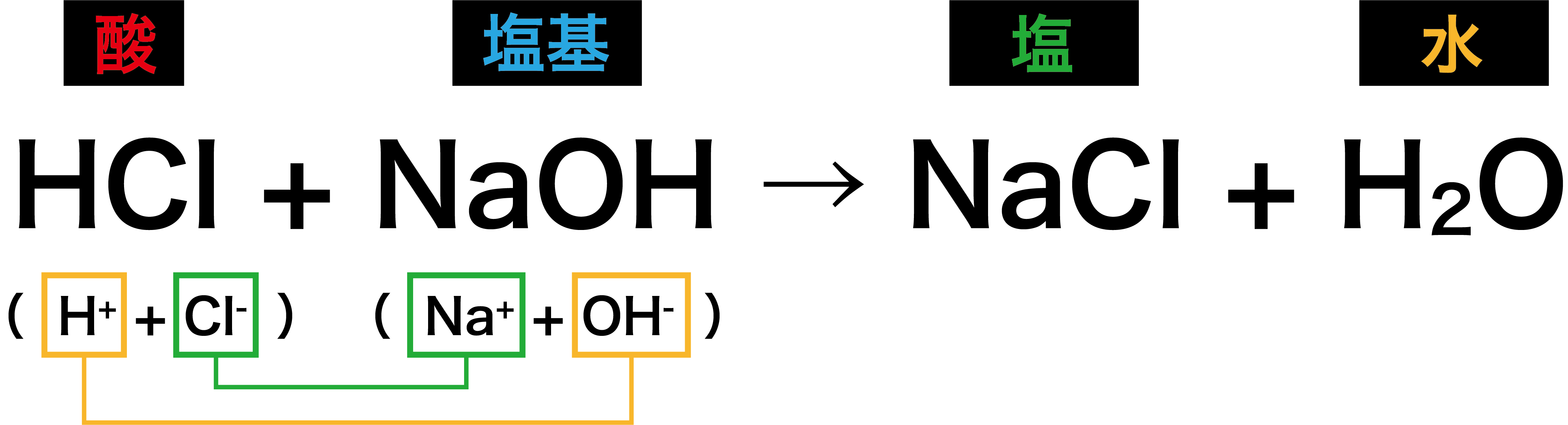
Mar 09, · 酸がhと塩基になる化学式にもある一定の定数によって定常状態が存在します。 その時の平衡定数を解離定数といい、スライドの式で表現されます。Apr 29, 14 · 教科書は実教出版「新版理科総合A」でした。酸と塩基についてのまとめノートです。 単元 化学反応とエネルギー, キーワード 化学,アレニウスの定義,ブレンステッド・ローリーの定義,電離度,弱酸,水素イオン指数,塩基性,中和滴定,中和点,先輩ノート,chemistry,科学酸と塩基がたがいの性質を打ち消しあい,水を生じる反応を(1 中和(中和反応) )という。 このとき,水と同時に(2 塩 )も生成する。 中和反応の化学反応式のつくり方 ① 酸・塩基を左辺に書く。 ② 酸・塩基の電離した状態を考える。




高1 強酸 強塩基 弱酸 弱塩基の分類一覧 高校生 化学のノート Clear



Q Tbn And9gcrsdoc1vqj Wfilguadvldyadr2c7k Frt9ek4grjzpgrpehrx6 Usqp Cau
第一次 酸と塩基 3時間(本時2/3) 第次 水の電離とpH 3時間 第三次 酸・塩基の中和と電離 8時間 授業について 高等学校「化学基礎」では,本時までに,イオン式や配位結合,イオン反応式など,「酸・塩基一方で、酸と反応して、その働きを弱める物質も昔から知られており、それは「塩基(base)」と呼ばれました。 「中和反応(neutralization)」とは、酸と塩基の化学反応のことです。 酸から生じる水素イオンH と、塩基から生じる水酸化物イオンOH とが、互いに水中での酸や塩基の 反応を取り扱う場合は,常 に,水 和が決定的影響を及ぼ すことを念頭に置かねばならない。水中での酸,塩 基の 解離や,構 造と強度について,若 干の物理化学的解析を 通じて,理 解を深めることを試みよう。 1 酸・塩基の概念定義




高等学校化学i 酸と塩基の反応 Wikibooks




高校化学基礎 酸と塩基の価数 練習編 映像授業のtry It トライイット
Jul 17, 18 · 生化学が絡んでくるので、化学式が出てきちゃうと難しく考えてしまいがちですよね(_) 私も、化学式を見ても酸塩基平衡が理解ができない人だったので、 今回は化学式を使わない酸塩基平衡の覚え方を、看護学生の国家試験対策向けに解説していきます!ですから、中和反応の化学反応式は酸が電離する反応式と、塩基が電離する反応式を並べて書いて、酸が放出するh の数と塩基が放出するohの数が等しくなるように足し合わせれば作る事ができます。 ちょっと練習してみましょう。 例題(1)Oct 24, 18 · hclは化学式中にhを1つもっているので1価の酸、ca(oh) 2 は化学式中に2つのohをもっているので2価の塩基となります。 ただし、アンモニアnh 3 はh を1つだけ受け取りnh 4 となるため 価数は1です。3ではありません 。 酸・塩基の価数の一覧 酸の価数一覧表



化学講座 第14回 酸と塩基 1 私立 国公立大学医学部に入ろう ドットコム




酸と塩基の分類 価数と電離度による見分け方 図解でわかる危険物取扱者講座
電離度が1に近い酸または塩基→強酸,強塩基 (例) HCl,H 2 SO 4 ,HNO 3 ,NaOH,KOH,Ca(OH) 2 電離度が小さい酸または塩基→弱酸,弱塩基 (例) CH 3 COOH,NH 3酸・塩基反応の例 nh3 h2o nh4 ho– 「h を与える」=酸 「h を受け取る」=塩基 注意:有機化学での「酸・塩基反応」は「水溶液中の 反応」とは限らない! (「酸・塩基といえば水溶液の電離」と決めつけないこと) 4したがって,酸塩基平衡を理解するためには腎臓と肺の生理機能を知る必要がある。 また,ほとんどすべての疾患の病態生理に酸塩基平衡異常が関係しており,酸塩基平衡の理解は臨 床における診断,治療に必須のものである。 1.酸(塩基)とは?(表1)



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する




2 2 3 電離平衡
酸の電離の様子を電離式で表す。 ・ それ以外の酸や塩基の電離の様子を電 離を示すイオン反応式で表す。 ・ 酢酸の化学式 ch 3 cooh は示す。 ・ 酢酸はh が2ヵ所 あるが,左側は電離し ないことを確認する。 ・ 酸や塩基の電離の 様子を電離を示すイJul 07, 01 · 化学 酸-塩基平衡 β-アラニンの滴定曲線を作成してpI・pKaの測定についてなのですが、β-アラニンにNaOHを使ってpH12とした後に HClを滴定して、pH2にしました。それで、Hender 質問No酸・塩基のNO.2 酸と塩基の定義 教科書p111の問1.硝酸HNO3、水酸化バリウムBa(OH)2が電離するようすを、 イオン反応式で表せ。 教科書p113の問2.右向きの反応において、水H2Oはブレンステッド・ローリーの定義による 酸・塩基のいずれのはたらきをしているか。




化学反応式 同種元素は左辺と右辺で等しい 反応に無関係な化合物を入れない Ppt Download



化学基礎の酸と塩基が中和反応するときの化学反応式について 反 Yahoo 知恵袋
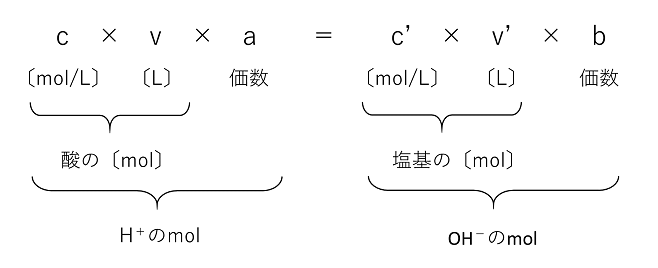
Aug 05, 17 · 酸であるhclが水素イオン(h )を出してcl – となり、塩基であるnh 3 がh を受け取ってnh 4 になっている。 ちなみに、cl – とnh 4 は組み合わさって塩化アンモニウムnh 4 clの白煙となる。 応用:オキソニウムイオンとブレンステッド・ローリーの定義 水溶液中で酸から生じ酸・塩基の各 1mol が放出したり受け取ったりできるH の物質量とは,酸,塩基の価数であるから,n〔価〕 の酸a〔mol〕とn'〔価〕の塩基b〔mol〕とが完全に中和すると次式が成立する。 (酸が放出するH の物質量) (塩基が受け取るH の物質量) a*n = b*n'Apr 26, 21 · 塩基がもつOH – の物質量(mol)は、「塩基の価数×塩基の物質量(mol)」で求めることができるため、 酸の価数×モル = 塩基の価数×モル が成り立ちます。



Http Tokyogakkan Lekumo Biz Todays Gakkan Files 2sousin Ri Kagaku 0519 Pdf




絶対忘れない 強酸 強塩基のゴロ合わせ Youtube



酸と塩基




Kohは強塩基ですか 弱塩基ですか Clear



中和 定義 塩 中和反応式の作り方など 化学のグルメ




Web教材イラスト図版工房 R Ch 酸と塩基 33




アスコルビン 酸 クエン 酸 塩基 化学式 Jameskingpo Over Blog Com
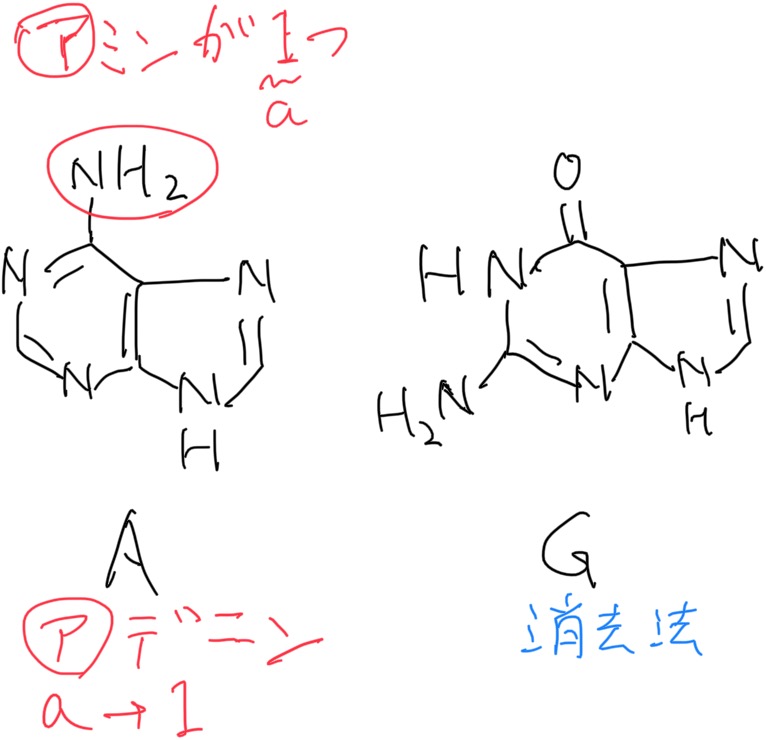



プリン塩基 ピリミジン塩基の構造式の見分け方 薬剤師国家試験 ユニーク暗記法



酸と塩基が中和するときの科学反応式 よくわかりません 回答お願い Yahoo 知恵袋




化学基礎 5章 酸と塩基の反応単語カード Quizlet



受験化学基礎 酸と塩基の定義 みかみの参考書ブログ




酸と塩基の分類 価数と電離度による見分け方 図解でわかる危険物取扱者講座




酸性条件 中性 塩基性条件 で酸化還元反応で何が変わる




化学式の名前の分からないところがあるので教えて欲しいです Clear




酸塩基平衡の基本 見て わかる 病態生理と看護 花子のまとめノート




化学式 一覧




よくわかる 血液ガス分析と酸塩基平衡 第1回 医療 看護 介護のセミナー 研修情報サイト メデュケーション



1



核酸の構造




6 1 酸と塩基 おのれー Note



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである




化学基礎 5章 酸と塩基の反応単語カード Quizlet




化学基礎 一問一答 高校 第2編 物質の変化 第2章 酸と塩基の反応
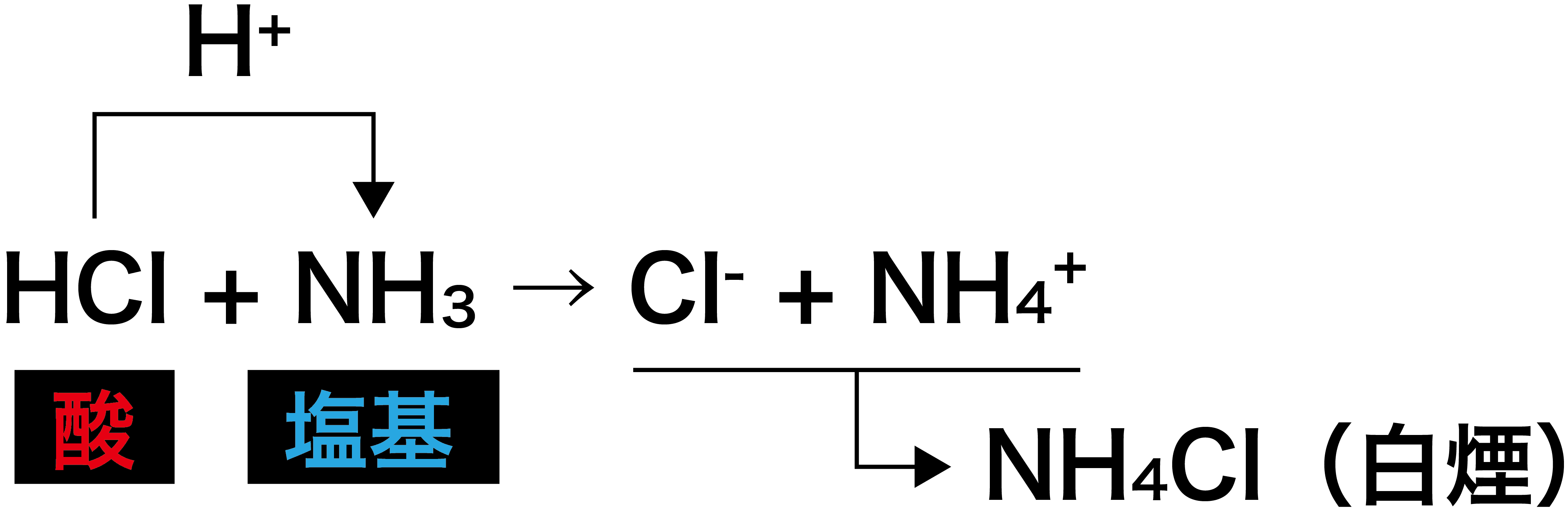



中和 定義 塩 中和反応式の作り方など 化学のグルメ
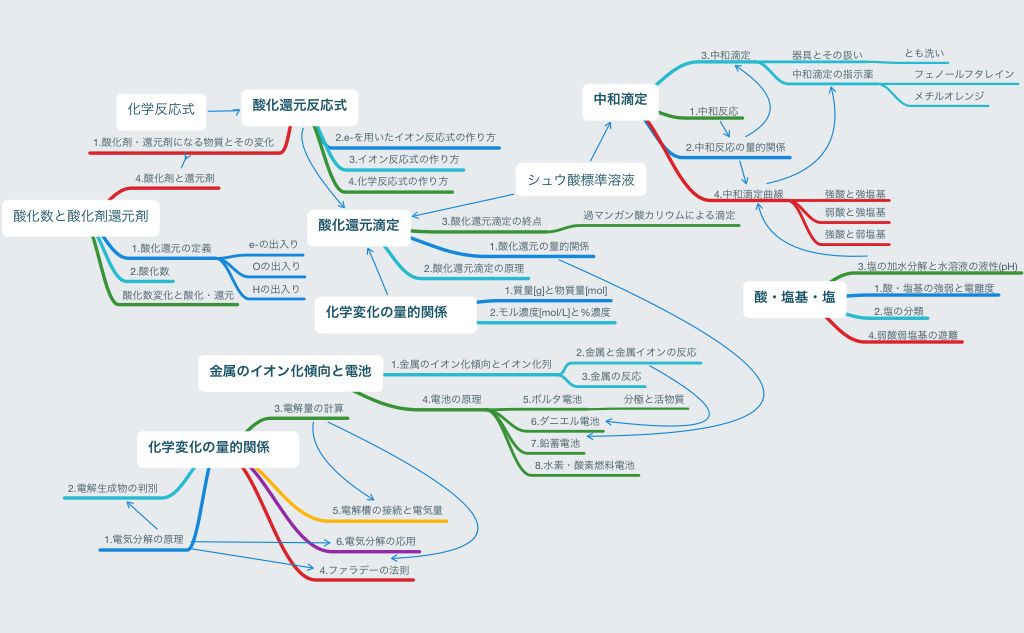



2学期中間テスト 酸化還元 酸塩基反応 マインドマップ 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ
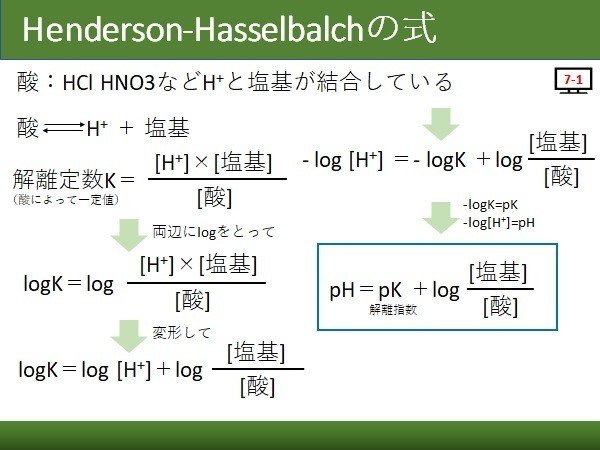



酸 塩基平衡を理解しよう その Henderson Hasselbalchの式 真鍋 Porcs代表 Note



化学の強塩基 弱塩基 強酸 弱酸の覚え方 語呂 また その化学式の覚 Yahoo 知恵袋




6 1 酸と塩基 おのれー Note
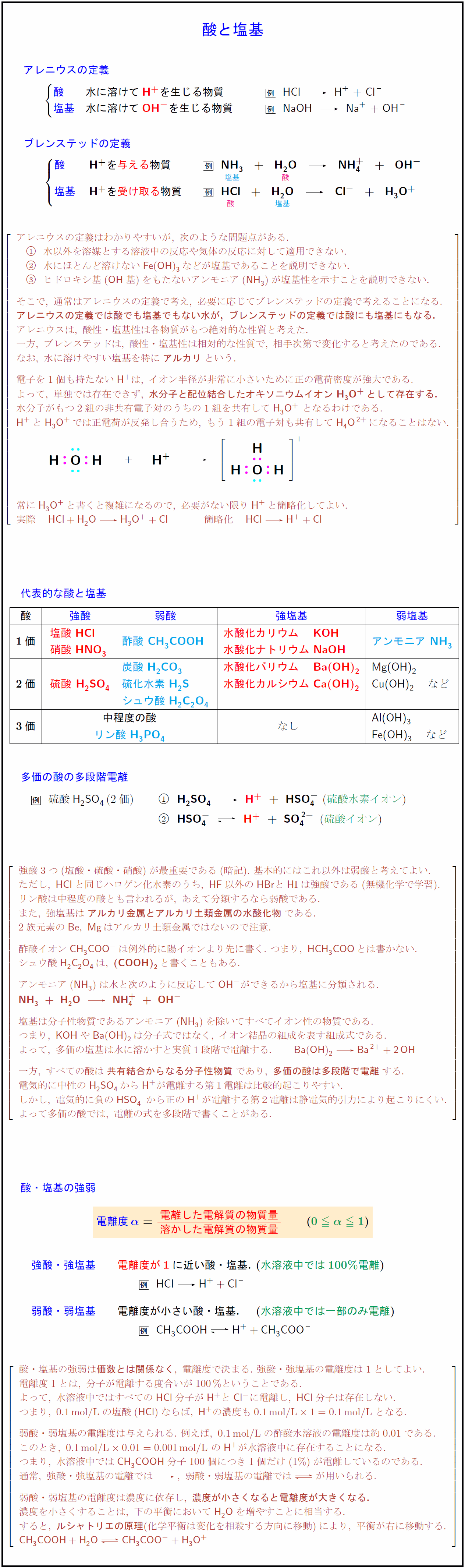



高校理論化学 酸と塩基の定義 代表的な酸と塩基 酸と塩基の強弱 受験の月
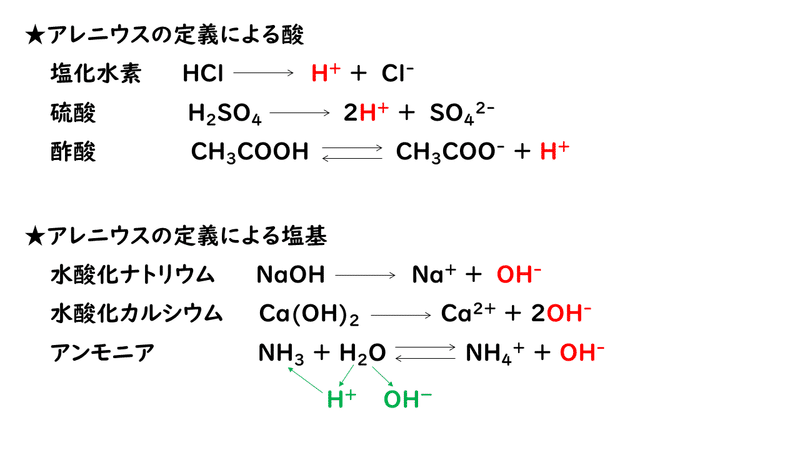



6 1 酸と塩基 おのれー Note
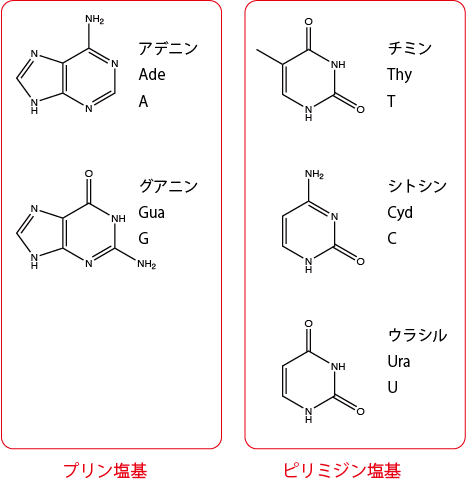



ヌクレオチドと核酸 Dnaとrnaの構造を解説 生命系のための理工学基礎




新品 フォローアップドリル 3冊 化学 物質の状態 化学基礎 物質量 化学反応式 酸 塩基 酸化 還元 電池 電気分解 数件出版 の落札情報詳細 ヤフオク落札価格情報 オークフリー スマートフォン版



酸 塩基 価数 一覧 覚え方 例など 化学のグルメ




強酸と弱酸まとめ 見分け方 理系ラボ




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠



1




酸 塩基の価数の意味 覚え方 一覧と多段階電離 Vicolla Magazine




酸 と 塩基 が打ち消し合う 中和 について元研究員が解説 Study Z ドラゴン桜と学ぶwebマガジン




プリン塩基 Wikipedia




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠



中和反応




11 Toe Lihat Cara Penyelesaian Di Qanda




化学 化学基礎 基礎的な問題ばかりだが多少難易度は高くなる 化学発展 気体 溶液 平衡の分野から やや難の計算問題が出る 大学受験パスナビ 旺文社




頻出 化学反応式 16 化学がちょっとだけ好きな社労士



共役酸と共役塩基とは



Www Pen Kanagawa Ed Jp Zushi H Hogosha Documents Chemistry0518 Pdf




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離 サイエンスストック 高校化学をアニメーションで理解する




高校化学基礎 酸と塩基の定義 練習編 映像授業のtry It トライイット



Http Heian Gacco Que Jp Sanenki Pdf




化学基礎 酸と塩基 強弱 テスト 高校生 化学のノート Clear



1




化学反応式 同種元素は左辺と右辺で等しい 反応に無関係な化合物を入れない Ppt Download



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである




1 C 1 13 Lihat Cara Penyelesaian Di Qanda




高校無機化学 酸と塩基の中和反応 受験の月




化学式 一覧 化学 完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離




炭素酸 化学式 H2co3 で化合物の三次元構造酸 塩基の恒常性を維持するために重炭酸バッファー システムで重要な役割を果たしています の写真素材 画像素材 Image




ヤフオク 特3 みんなのセンター教科書 化学基礎




酸 と 塩基 が打ち消し合う 中和 について元研究員が解説 Study Z ドラゴン桜と学ぶwebマガジン




塩の加水分解 理系ラボ




酸と塩基の分類 価数と電離度による見分け方 図解でわかる危険物取扱者講座




高校化学基礎 酸と塩基の性質 練習編 映像授業のtry It トライイット



酸と塩基 酸と塩基の強さ



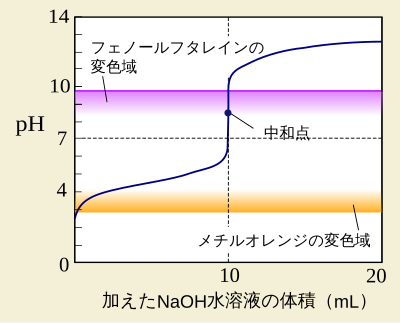
弱酸 弱塩基の遊離 化学基礎 高校化学net参考書



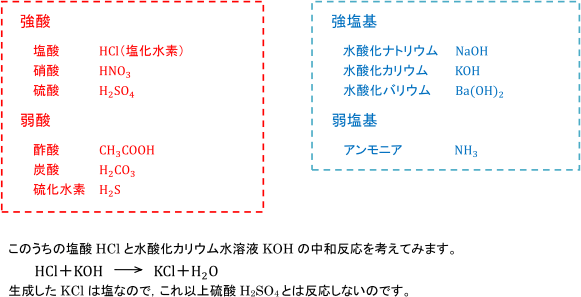
高等学校化学i 酸と塩基の反応 Wikibooks




Ppt 化学反応式 化学式を用いて化学変化を書いた式 や で反応系と生成系を結ぶ イオン反応式 水溶液での反応で 関与する分子 イオンのみを含む で結ぶ Powerpoint Presentation Id




高校化学 酸 塩基 酸 塩基の価数 オンライン無料塾 ターンナップ Youtube



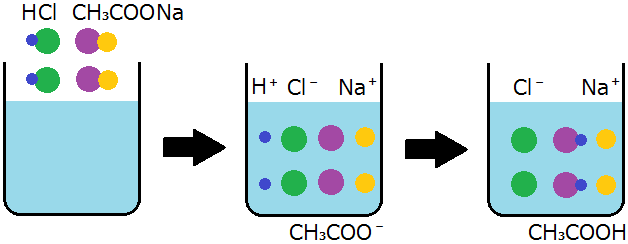
中和反応と塩 塩化カリウムと硫酸が反応しないのはなぜですか 化学基礎 定期テスト対策サイト




酸塩基化学 Japaneseclass Jp



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである



Dnaの基本構造 ヌクレオチド Dnaの構造と複製 Ns遺伝子研究室




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠




樅山 Mutsuha Asada 今日 化学レポートで中性 塩基性条件で過マンガン酸カリウムと過酸化水素水の反応の化学式を書くためにごちゃごちゃやってたけど謎の水素イオンはどこからやって来ているのかわからなかったのでもし良ければ教えてください




理論 酸塩基 1 受験 定期テストで高校化学を完全攻略




高校化学基礎 酸と塩基の価数と強弱 映像授業のtry It トライイット




高校化学基礎 酸と塩基 中和反応の基本 中和反応の化学反応式 Youtube




酸 塩基 価数 一覧 覚え方 例など 化学のグルメ



この化学式の名称と もとの酸 塩基の化学式を教えてくださいm M Yahoo 知恵袋




宇宙一覚えやすい 化学反応式ハンドブック Amazon Com Books



Http Heian Gacco Que Jp Sanenki Pdf
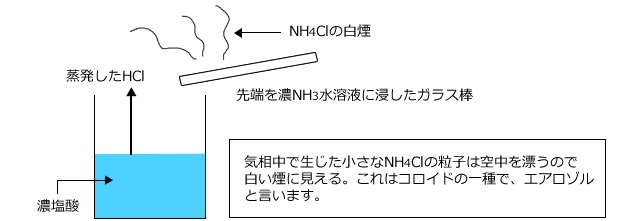



化学講座 第14回 酸と塩基 1 私立 国公立大学医学部に入ろう ドットコム




どうして 矢印が2本あるんですか 問題 次の塩基の化学式を記せ 答 化学 教えて Goo



Ppt 化学反応式 化学式を用いて化学変化を書いた式 や で反応系と生成系を結ぶ イオン反応式 水溶液での反応で 関与する分子 イオンのみを含む で結ぶ Powerpoint Presentation Id




4章 ファンデルワールス結合とファンデルワールス結晶 分子性結晶 Ppt Download




高校化学基礎 酸と塩基の性質 練習編 映像授業のtry It トライイット




化学基礎 物質の変化21 酸と塩基の価数 8分 Youtube



酸と塩基



リン酸 You Iggy




大学入試レベルの問題で 自身で酸と塩基の強弱を判断する必要のあるものは出てきますか Clear



0 件のコメント:
コメントを投稿